Johtuuko tämä siitä, että se suosii eniten elektronien jakamista ja sidosten muodostamista, vai onko se vakainta, vai onko olemassa parempaa syytä?
Ensimmäinen järkeistämisesi on hyvä. Tästä syystä vähiten elektronegatiivisesta elementistä tulee yleensä keskeinen elementti. Tästä huolimatta on olemassa poikkeuksia. Yksi on vesi. Happi on paljon enemmän elektronegatiivista kuin vety, mikä viittaa siihen, että vedyn tulisi olla keskeinen atomi, mutta vedyt ovat selvästi perifeerisiä atomeja. Tämä johtuu rajoituksesta, että vety voi muodostaa vain yhden sigmasidoksen. Tästä huolimatta vetyä on löydetty myös epätavallisista sidosjärjestelyistä (katso esimerkki diboraanista).
Miksi monet molekyylit ovat symmetrisiä? Onko mikään syy siihen, miksi symmetria luonnossa ja kemiassa on parempana kuin ei-symmetria?
Molekyylien symmetrisillä konformaatioilla voi olla vähemmän energiaa kuin epäsymmetrisillä vastineillaan. Tarkastellaan kolminkertaista interhalogeenia, $ \ ce {IBrF2} $. Symmetrinen konformaatio on todennäköisesti vähemmän energiaa kuin epäsymmetrinen konformaatio (piirrä Lewisin rakenteet nähdäksesi).
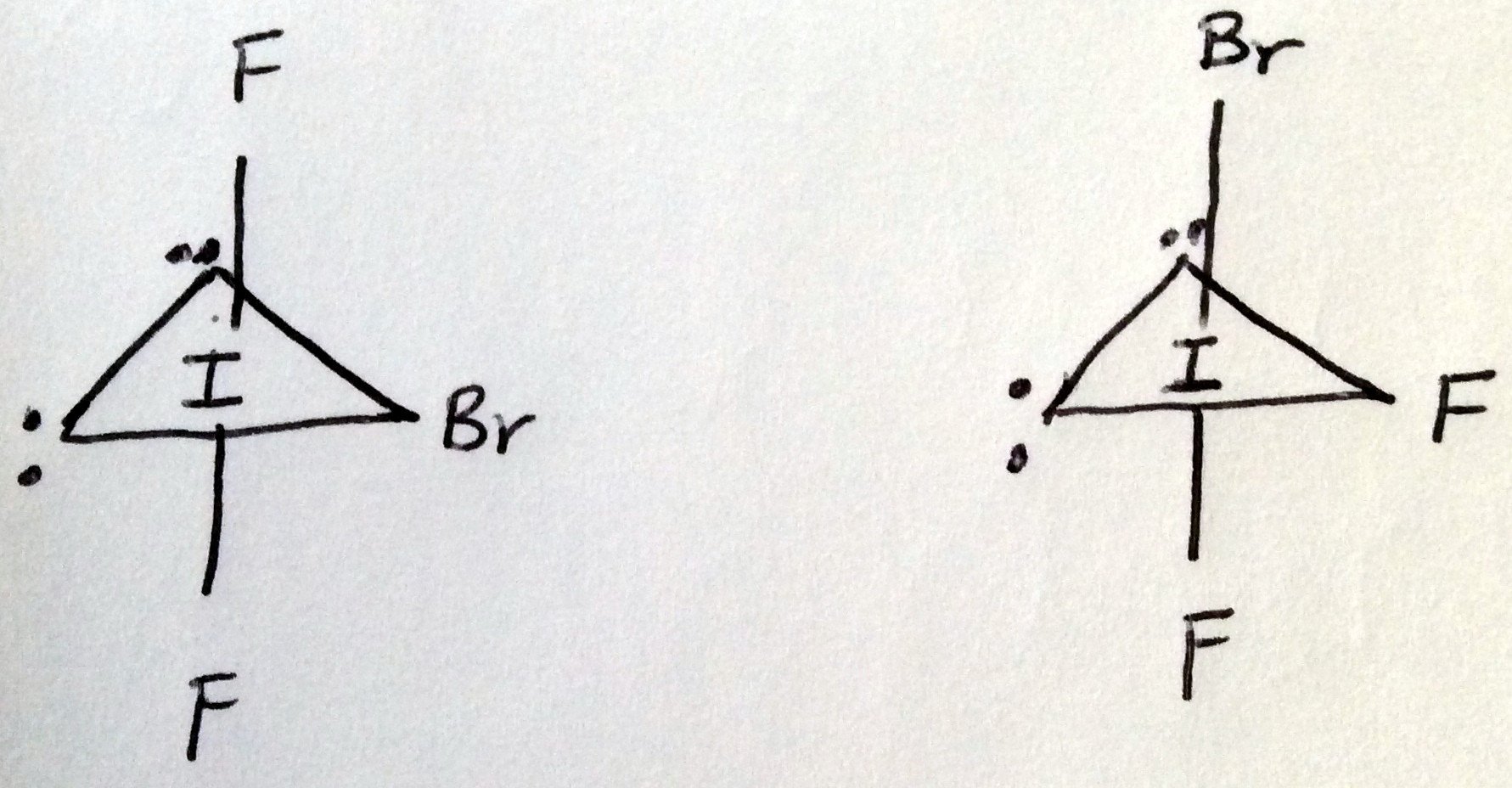
Kuten näemme, symmetrisessä konformaatiossa (vasemmalla) on vain 90 asteen fluori / yksinäinen -parin vuorovaikutus, toisin kuin oikeanpuoleinen konformaatio, jossa on fluori / yksinäinen vuorovaikutus bromi / yksinäinen -parin vuorovaikutuksen lisäksi. Ekvatoriaalisesti sijoitetut atomit on jätetty pois tästä näkökohdasta, koska ne ovat ~ 120 astetta yksinäisten parien päässä, joten niiden vuorovaikutukset eivät ole yhtä merkittäviä kuin 90 asteen aksiaalisen / yksinäisen parin vuorovaikutukset.
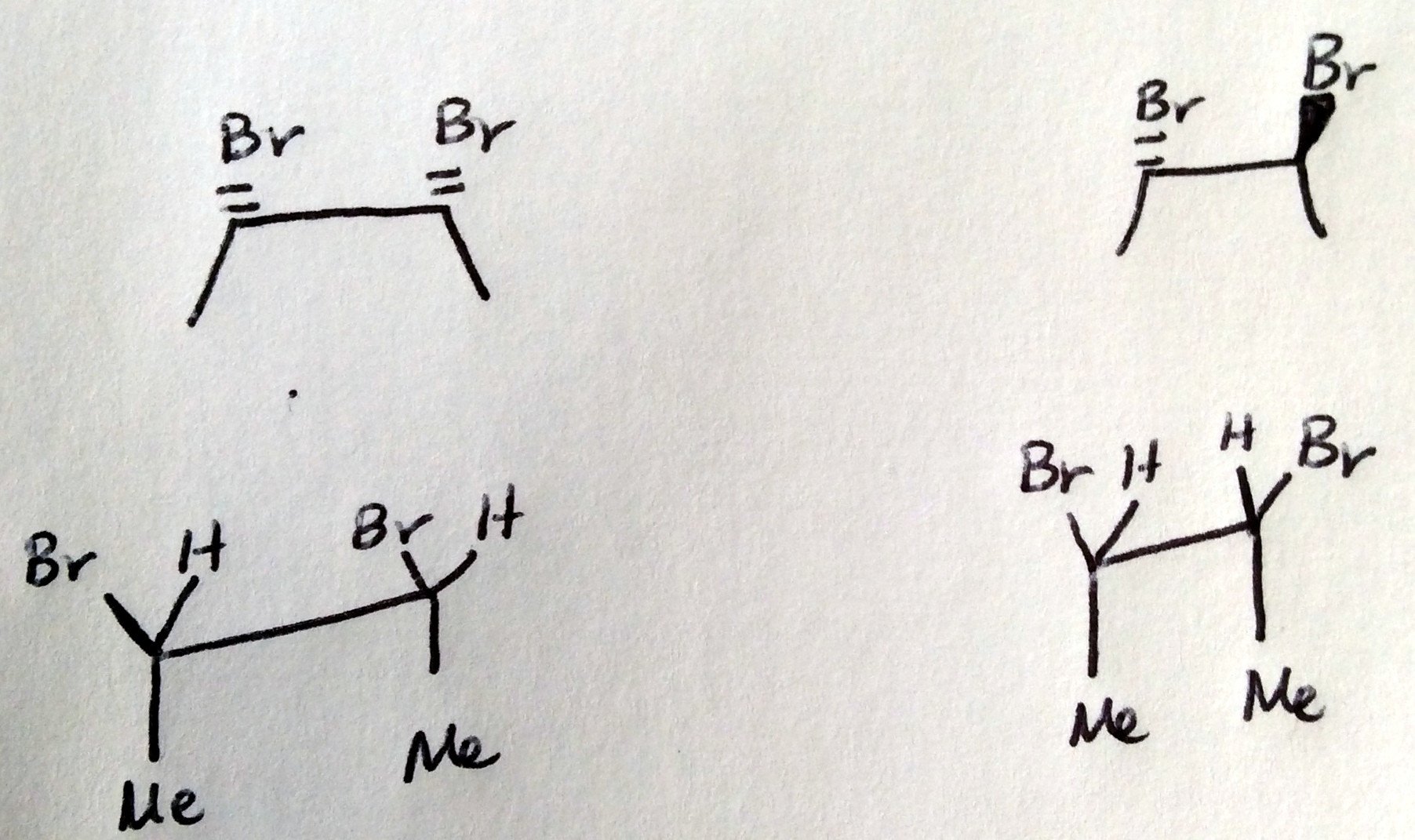
Tästä huolimatta on lukemattomia poikkeuksia. Otetaan huomioon 2,3-dibromibutaanin pimennykset (vasemmalla) ja pimenemättömät (oikealla). Pimennyt konformaatio on symmetrinen (se on myös meso ; kaikki meso-yhdisteet ovat symmetrisiä, mutta kaikki symmetriset yhdisteet eivät ole meso). Pimenemätön konformaatio on epäsymmetrinen. Pimenemätön konformaatio on kuitenkin energeettisesti edullinen, koska bromien pimennys asettaa ne lähemmäksi toisiaan, mikä luo enemmän van der Waalsin hylkimyksiä.
Lisäksi symmetria on monimutkainen aihe kemiassa, etenkin monimutkaisempien molekyylien ja entiteettien suhteen.